ОБЕСПЕЧЕНИЕ КАЧЕСТВА СБОРА ПЕРВИЧНЫХ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ ПРИ ОКАЗАНИИ ЭКСТРЕННОЙ И НЕОТЛОЖНОЙ ПОМОЩИ Методические рекомендации Москва 2016
Обеспечение качества сбора первичных биологических образцов для лабораторных исследований при оказании экстренной и неотложной помощи. Методические рекомендации. - Москва, 2016. - 26 с.
В методических рекомендациях подробно описана процедура взятия первичных биологических образцов для проведения лабораторных исследований: артериальной крови для исследования кислотно-основного состояния, венозной крови из внутривенных катетеров и мочи из мочевых катетеров. В основу положены современные международные стандарты CLSI, связанные с оказанием экстренной и неотложной помощи.
Методические рекомендации предназначены в помощь организаторам здравоохранения, заведующим отделениями реанимации, а также заведующим и специалистам клинико-диагностических лабораторий лечебно-профилактических учреждений, главным медицинским сестрам и медицинским сестрам отделений реанимации, урологических и терапевтических отделений.
Авторы-составители:
Гильманов А.Ж. - заведующий кафедрой биохимии и лабораторной диагностики ГОУ ВПО «Башкирский государственный медицинский университет», д.м.н., профессор
Ковалевская С.Н. - председатель комитета по преаналитике Ассоциации «Федерация лабораторной медицины», член-корреспондент рабочей группы по преаналитике Европейской федерации лабораторной медицины (EFLM)
Лянг О.В. - вице-президент Ассоциации «Федерация лабораторной медицины», доцент кафедры госпитальной терапии с курсом КЛД РУДН, к.б.н.
Сашков В.А. - доцент кафедры биологии и биотехнологии Московского государственного педагогического университета им В.И. Ленина, к.б.н.
Рецензенты:
Начальник сектора КЛД СПб ГБУЗ МИАЦ, заслуженный врач РФ, д.м.н., профессор кафедры клинической лабораторной диагностики с курсом молекулярной медицины ПСПб ГМУ им. ак. И.П. Павлова А.И. Карпищенко
Президент Федерации лабораторной медицины, главный внештатный специалист Минздрава России по клинической лабораторной диагностике, д.м.н., профессор А.Г. Кочетов
Заведующая кафедрой сестринского дела ПСПб ГМУ им. ак. И.П. Павлова, д.м.н., профессор Н.Г. Петрова
Заведующий кафедрой клинической лабораторной диагностики с курсом молекулярной медицины СПб ГМУ им. ак. И.П. Павлова, д.м.н., профессор В.Л. Эмануэль
ОГЛАВЛЕНИЕ
Введение...................................................................................................................4
Термины и определения....................................................................4
Уровень доказательности рекомендаций.............................................................. 6
Рекомендации по взятию артериальной крови для исследования кислотно-
основного состояния.............................................................................................10
Рекомендации по взятию крови для лабораторных исследований из внутривенных катетеров...................................................................................................16
Рекомендации по взятию мочи для лабораторных исследований из мочевых катетеров................................................................................................................20
Заключение.............................................................................................................24
Список литературы................................................................................................25
Эффективность лечебно-диагностической работы медицинских организаций во многом определяется качеством клинической лабораторной диагностики в связи с тем, что лабораторная информация используется в принятии примерно 70% медицинских решений. Назначая какое-либо исследование, врач должен оценить возможное влияние на его результат общего статуса пациента, условий подготовки, вида и времени взятия биоматериала [5].
Правила пробоподготовки и транспортировки биоматериала (преанали-тический этап лабораторной диагностики) при неотложных состояниях имеют ряд особенностей. К ним относятся: проводимая инфузионная терапия для пациентов реанимационных отделений, катетеризация вен и мочевого пузыря, а также необходимость частого взятия биологического материала на исследование в течение суток. Эти факторы, наряду с другими (выбор типа биологического материала для исследования, метод взятия, правильная и своевременная доставка в лабораторию) могут оказать существенное влияние на качество результатов анализов [15].
Вследствие лабораторных ошибок пациенты могут получать неправильное лечение, которое может привести к ухудшению состояния здоровья. Кроме того, больным зачастую назначаются ненужные дополнительные исследования, которые могут привести к удлинению сроков лечения в стационаре.
Предлагаем специалистам соответствующего профиля методические рекомендации, в которых подробно рассмотрены основные подходы к обеспечению качества сбора первичных биологических образцов для лабораторных исследований при оказании экстренной и неотложной помощи.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ CLSI - институт клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute).
EMBASE - Excerpt Medical data BASE, интегрированная веб-платформа, выполняющая роль интеллектуального шлюза для доступа к высококачественной, современной и достоверной медико-биологической и фармакологической информации. Данный библиографический ресурс содержит более чем 24 миллиона записей (повторяющиеся статьи исключены) из баз EMBASE и MEDLINE, представленных в более чем 7,6 тыс. журналах за период с 1947 г. по настоящее время. Большинство библиографических записей имеет расширенный реферат статьи. Некоторые статьи могут быть представлены полностью.
Medline (MEDlars onLINE) - крупнейшая библиографическая база статей по медицинским наукам, созданная Национальной медицинской библиотекой США (U.S. National Library of Medicine, NLM).
4
Аналит - компонент пробы, указанный в названии измеряемой величины Валидизация — (лат. validus - крепкий, здоровый) - 1. процесс определения формальной (логической) правильности некоторого суждения или заключения; 2. процесс оценки степени, в которой тест или другой измерительный инструмент измеряет то, для измерения чего он предназначен. Венепункция - все этапы получения соответственно идентифицированного образца крови из вены пациента.
Взятие пробы - процесс изъятия или образования проб, охарактеризованный процедурой их взятия.
Гомеостаз — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Емкость (для взятия образца) - сосуд, вакуумный или невакуумный, предназначенный для помещения образца, с принадлежностями и добавками, закрытый крышкой. Принадлежность емкости для взятия образца представляет собой компонент внутри емкости, предназначенный для участия во взятии, или смешивании, или в разделении образца
КОС (кислотно-основное состояние) - показатель гомеостаза организма. Кохрановская библиотека - электронная база данных международной некоммерческой организации «Кохрановское Сотрудничество» (Cochrane Collaboration). Ее основная задача - собирать новейшую, достоверную информацию о результатах медицинских вмешательств. Строго доказанные научные факты необходимы для оказания квалифицированной медицинской помощи - лучший источник для получения научного обоснования эффективности лечебных вмешательств. Кохрановская библиотека обновляется ежеквартально и распространяется по подписке на компакт-дисках или через Интернет.
Критерий качества - это количественная характеристика одного или нескольких свойств продукции, входящих в её качество, рассматриваемая применительно к определённым условиям её создания и эксплуатации. Люэр-адаптер - специальное устройство, которое имеет на одном конце коннектор для игл Люэра или игл-бабочек, на другом - иглу для прокола крышки вакуумной пробирки, изготовленную из нержавеющей стали и закрытую резиновым колпачком.
Обеспечение качества - вся планируемая и систематическая деятельность, осуществляемая в системе качества, и представленная, насколько необходимо, для создания соответствующей уверенности, что удовлетворяет требованиям по качеству.
Образец - биологический материал, полученный с целью обнаружения свойств или измерения одной или нескольких величин
Преаналитический этап лабораторных исследований - процедуры, хронологически начинающиеся с назначения клиницистом исследования, включая исследования в заявку, подготовку пациента, взятие первичной пробы, цен
5
Проба - одна или более частей, взятых из системы с целью получения информации о системе, которая часто может использоваться в качестве основы для принятия решения о системе или ее деятельности.
Стабильность - способность системы, содержащейся в определенных условиях, поддерживать установленное значение свойства в определенных пределах в течение определенного времени.
Стерильность - отсутствие всех видов живых микроорганизмов на поверхностях, оборудовании, в пищевых продуктах и лекарствах. Хорошая лабораторная практика (Good Laboratory Practice, GLP) - организация процесса и условий, в соответствии с которыми лабораторные исследования планируются, выполняются, их результаты отслеживаются, регистрируются и сообщаются.
УРОВЕНЬ ДОКАЗАТЕЛЬНОСТИ РЕКОМЕНДАЦИИ
Описание методов, использованных для сбора/селекции доказательств: доказательной базой разработанных рекомендаций являются публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE, электронную библиотеку (www.e-library.ru). Глубина поиска составляла 10 лет.
Методы, использованные для оценки качества и силы доказательств: консенсус экспертов.
Методы, использованные для анализа доказательств: обзоры опубликованных мета-анализов.
Оценка уровня доказательности и значимости рекомендаций производилась в соответствии с данными, изложенными в таблице 1.
Таблица 1
Оценка уровня доказательности рекомендаций
Уровень рекомендаций
Оценка рисков и преимуществ
1A.
Сильные рекомендации, высокий уровень доказательности
Преимущества существенно превышают риски
Качество доказательности
Данные хорошо проведенных рандомизированных контролируемых исследований или убедительных доказательств в какой-либо другой форме. Дальнейшие
Применение
Сильные рекомендации, могут применяться безоговорочно для большинства пациентов в большинстве случаев. Клиницисты
6
т
|
|
|
исследования вряд ли изменят доказательность в оценке рисков и преимуществ |
должны следовать этим рекомендациям при отсутствии альтернативного подхода |
|
1Б. Сильные рекомендации, средний уровень доказательности |
Преимущества существенно превышают риски |
Данные рандомизированных контролируемых исследований с ограничениями (противоречивые результаты, методологические недостатки), или убедительные доказательства какого-либо исследовательского проекта. Дальнейшие исследования могут оказать влияние на доказательность в оценке рисков и преимуществ и изменить текущую оценку |
Сильные рекомендации, могут применяться к большинству пациентов. Клиницисты должны следовать этим рекомендациям при отсутствии альтернативного подхода |
|
1С. Сильные рекомендации, низкий уровень доказательности |
Преимущества превышают риски |
Данные наблюдений, бессистемного клинического опыта, или рандомизированных контролируемых исследований с существенными ограничениями. Любая оценка эффекта является неопределенной |
Сильные рекомендации, могут применяться к большинству пациентов. Некоторые источники доказательной базы, поддерживающей эти рекомендации, невысокого качества |
|
2A. Слабые рекомендации, высокий уровень доказательности |
Преимущества и риски сбалансированы |
Данные хорошо проведенных рандомизированных контролируемых исследований или убедительных доказательств в какой-либо другой форме. Дальнейшие исследования вряд ли изменит доказательность в оценке рисков и преимуществ |
Слабые рекомендации, эффект может отличаться в зависимости от условий, категории пациентов и пр. |
|
2B. Слабые рекомендации, средний уровень доказательности |
Преимущества и риски сбалансированы, имеется неопределенность в |
Данные рандомизированных контролируемых исследований с ограничениями (противоречивые результаты, методологические недостатки), или убе- |
Слабые рекомендации, могут иметься альтернативные подходы для некоторых категорий пациентов при определенных условиях |
7
Слабые рекомендации, низкий уровень доказательности
Т
оценке преимуществ
Т
Преимущества и риски могут быть сбалансированы, имеется неопределенность в оценке рисков и преимуществ
дительные доказательства какого-либо исследовательского проекта. Дальнейшие исследования могут оказать влияние на доказательность в оценке рисков и преимуществ и изменить текущую оценку
Т
Данные наблюдений, бессистемного клинического опыта, или рандомизированных контролируемых исследований с существенными ограничениями. Любая оценка эффекта является неопределенной
Т
Очень слабые рекомендации, альтернативные подходы применимы в равной степени
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств была проанализирована использованная различными авторами методология с целью определения ее валидности.
Индикаторы доброкачественной практики (Good Practice Points — GPPs): рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Метод валидизации рекомендаций: •S внешняя экспертная оценка; •S внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которые оценили, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания. Получены положительные комментарии со стороны заведующих отделениями и медицинских сестер отделений реанимации, заведующих лабораториями в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики. Комментарии тщательно систематизировались, и обсуждались председателем и членами рабочей группы. Все вносимые изменения регистрировались. Если изменения не вносились, то регистрировались причины отказа от внесения изменений. Какие-либо различия в оценках обсуждались уже всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
8
Предварительная версия предлагается для широкого обсуждения на сайте Федерации лабораторной медицины (http://www.fedlab.ru) для того, чтобы лица, не участвующие в заседании комитета, имели возможность принять участие в обсуждении и совершенствовании рекомендаций. Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Комитет по преаналитике:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами комитета по преаналитике ФЛМ, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации: уровни доказательности рекомендаций приводятся при изложении текста ниже.
Ведение клинических рекомендаций (протокола): осуществляется СПб ГБУЗ КБ Святителя Луки. Система ведения предусматривает взаимодействие СПб ГБУЗ КБ Святителя Луки со всеми заинтересованными организациями.
9
СОСТОЯНИЯ
(уровень доказательности 1А)
КОС (кислотно-основное состояние) - показатель гомеостаза организма. Физиологические механизмы регуляции КОС связаны с транспортом газов, кислых и основных эквивалентов кровью в легкие и почки, функциональной активностью легких, направленных на удаление избытка СО2, и почек, обеспечивающих реабсорбцию бикарбоната, удаление избытка ионов водорода и формирование бикарбонатного резерва крови [3].
При сдвигах рН в клетках изменяется активность практически всех ферментов, что ведет к быстрым сдвигам метаболизма, развитию клеточного энергодефицита, и, в конечном итоге, к нарушению жизнедеятельности клеток, тканей, органов, систем органов и организма в целом. Оценивая динамику показателей КОС, можно судить о тяжести развивающейся патологии, динамике состояния пациента и об адекватности терапии. По утверждению CLSI - Института клинических и лабораторных стандартов [14], результаты анализа КОС являются более значимыми для оценки состояния и выбора тактики лечения пациента, находящегося в критическом состоянии, чем любой другой вид исследований.
Анализ КОС относится к виду диагностики «у постели больного», когда по жизненным показаниям параметры определяются на газоанализаторах, максимально приближенных к пациенту. Показатели КОС связаны с состоянием пациента в данный момент времени (частота дыхания, артериальное давление, пульс, температура тела, физическая активность, функции почек и т.д.), результаты анализа КОС быстро изменяются. Поэтому важно, чтобы клиницист знал о текущем состоянии КОС у пациента, а не оперировал данными, полученными несколько часов назад. Общее время выдачи результатов анализа КОС по ряду наиболее критичных показателей не должно превышать 5-15 мин [1].
Хотя параметры КОС можно определять в артериальной, венозной и капиллярной крови, для анализа рекомендовано брать артериальную кровь из-за большей стабильности газового состава и метаболических параметров
[14].
В венозной крови содержатся продукты тканевого метаболизма; ее газовый состав менее постоянен, в значительной степени зависит от периферического кровотока, и не обеспечивает «репрезентативности» в отношении целого организма.
Так называемая «капиллярная кровь», забираемая у взрослых из пальца или у маленьких детей из боковой поверхности пятки - смешанная, в капил
10
При исследовании и расчете показателей КОС, кроме точного измерения рН, определяют газы крови - парциальное давление СО2 и О2, tHb, SO2. Современные анализаторы неотложных состояний способны в одной капле крови определять и другие жизненно важные параметры: концентрацию электролитов (Na+, K+, Ca2+, Cl-, Li+), некоторых метаболитов (глюкозы, лак-тата, мочевины, креатинина), гемоглобина, а также значение гематокрита.
Наиболее строгие требования к подготовке пациента, взятию биоматериала и первичной обработке пробы предъявляются именно при оценке КОС. Только при выполнении этих требований можно быть уверенным в надежности определения перечисленных выше жизненно важных параметров организма.
Ключевое значение для обеспечения надежности данных имеет преана-литический этап лабораторных исследований, который при анализе электролитов и КОС имеет ряд важных особенностей [18]:
1. Необходимо, чтобы состояние пациента оставалось стабильным минимум 20 мин (особенно после окончания или прерывания лечебных и диагностических процедур), а параметры дыхания оставались неизменными в течение хотя бы 5 минут до взятия крови, иначе показатели КОС могут быть искаженными. Причинение боли во время взятия крови может вызвать гипервентиляцию и, соответственно, сдвиги результатов анализа, поэтому перед взятием артериальной крови желательно обезболить место пункции, например, лидокаином или специальным пластырем.
2. Перед взятием крови из лучевой артерии нужно убедиться в наличии кровотока по параллельно идущей локтевой артерии (у некоторой части пациентов он недостаточен). Это даст уверенность в сохранении кровоснабжения кисти руки даже после возможного временного нарушения кровоснабжения (тромбоза) лучевой артерии в месте пункции. Методика выполнения пробы Аллена включает одновременное прижатие лучевой и локтевой артерий на 10-20 с и наблюдение за восстановлением розового цвета кисти после освобождения локтевой артерии (рис. 1). Для этого лучевая и локтевая артерии пережимаются, пациента просят сжать кулак, чтобы обескровить кисть. Кулак необходимо держать выше уровня сердца. Если пациент находится в состоянии анестезии, кровь может быть дренирована ассистентом, сжимающим кисть. После этого кулак медленно разжимают, и кисть опускается до уровня сердца. Снимается давление только с локтевой артерии и засекается время, за которое кисть наполнится кровью. Нормальный результат: менее 7 секунд, пограничный - 7-15 секунд, нарушение - более 15 секунд.
11
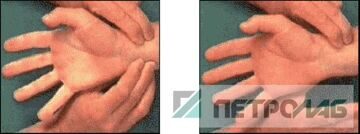
Рис. 1. Тест Аллена - проверка коллатерального кровообращения в кисти
3. При выполнении артериальной пункции очень важно следить за тем, чтобы игла попала именно в артерию, а не в находящуюся рядом вену. Примесь венозной крови в шприце может исказить уровень СО2 (завышение) и особенно О2 (занижение). В случае ошибочной пункции вены, сквозного прокола сосуда и остановки тока крови не следует «искать» артерию движениями иглы, так как это причиняет сильную боль пациенту; лучше наложить давящую повязку в месте пункции и повторить взятие крови в другом месте.
4. Для взятия крови на анализ КОС в качестве антикоагулянта применяется сбалансированный по кальцию гепаринат лития в концентрации 50 IU/ml. Использование ЭДТА или цитрата натрия для этих целей не рекомендуется, так как может значительно изменить pH пробы. Для взятия крови могут использоваться:
• Обычные шприцы, которые предварительно ополаскивают раствором гепарина. Однако при этом могут наблюдаться такие побочные эффекты, как непрогнозируемое разбавление пробы (влияет на уровень гемоглобина и электролитов), изменение концентрации гепарина, уровня ионов кальция в образце, возрастание концентрации ионов натрия [13].
• Специальные шприцы с напыленным на внутренние стенки сухим ге-паринатом лития или натрия. Их использование позволяет избежать разбавления образца, повысить качество и стабильность пробы. Кроме того, использование шприцов, гепаринизированных в заводских условиях, позволяет минимизировать количество ручных манипуляций и сократить время подготовки к взятию пробы [1]. Использование шприцов с гепаринатом лития препятствует ложному возрастанию уровня натрия в образце, а с гепарином, сбалансированным по кальцию, позволяет избежать ошибок при определении ионизированного кальция;
5. Если кровь берется из сосудистого катетера, необходимо предварительно удалить остатки вводившихся через него растворов. Для этого из катетера отбирают и удаляют кровь в количестве не менее 3-6 его объемов, что обычно составляет 3-5 мл.
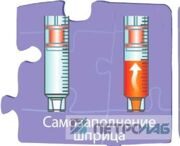
6. Шприцы для взятия артериальной крови имеют объем 1 или 3 мл и должны быть заполнены до отметки 0,6 и 1,6 мл (соответственно) для достижения оптимальной концентрации антикоагулянта в образце [1]. Заполнение шприца может производиться (рис. 2):
12
Аспирация
Рис. 2. Методы заполнения шприцов
• А) способом самозаполнения: поршень шприца заранее устанавливается на нужный объем, и после введения иглы в артерию заполнение шприца происходит самопроизвольно - под давлением крови. Остаточный воздух при этом удаляется через специальную мембрану в поршне.
• Б) аспирационным способом: после пункции артерии поршень шприца медленно оттягивается до нужной метки, и шприц при этом заполняется кровью.
7. При взятии артериальной крови рекомендуется использовать шприцы с безопасными иглами с защитными колпачками, «защелкивающимися» на иглу сразу после ее извлечения из кровеносного сосуда, чтобы избежать случайного укола иглой медработника (рис. 3). Дальше игла снимается со шприца, а его канюля (Люэр - или Люэр-Лок) после удаления пузырьков воздуха герметично закрывается крышкой или резиновым колпачком (рис. 4). Если игла остается на шприце, для герметизации на нее можно надеть специальный эластичный кубик (рис. 4). Перед постановкой шприца в газоанализатор колпачки и иглы со шприца снимаются.
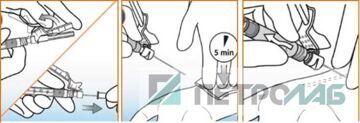
Рис. 3. Взятие артериальной крови на КОС путем пункции артерии.
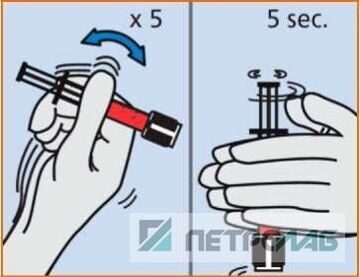
8. Сразу после взятия крови, чтобы избежать образования сгустков, образец необходимо перемешать путем 5-кратного переворачивания и перекатывания шприца между ладонями в течение 5 секунд (рис. 5). Эту же процедуру желательно провести и непосредственно перед анализом - для перемешивания содержимого шприца и предупреждения ошибок, вызванных оседанием клеток.
13
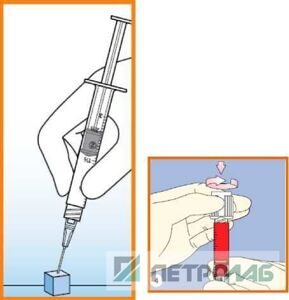
Рис. 4. Пример изоляции образца от контакта с воздухом, когда игла закрывается резиновым кубиком
Если берется капиллярная кровь, качественное перемешивание крови с гепарином в капилляре возможно только с помощью магнитного стерженька-мешалки, помещаемого пинцетом в капилляр перед закрытием его второго конца колпачком, и постоянного магнита, которым затем несколько раз проводят вдоль капилляра (в разные стороны).
9. Взятая кровь не должна соприкасаться с воздухом во избежание изменений газового состава и искажения результатов исследования. Оставленный в шприце пузырек воздуха, в зависимости от размеров и времени инкубации до анализа, способен исказить результаты определения О2 и СО2 на 10-25 %. Поэтому немедленно после взятия крови в шприц, необходимо удалить из него все пузырьки воздуха (при необходимости - с несколькими каплями крови) и герметично закрыть канюлю резиновым колпачком или специальной крышкой (рис. 4). При взятии капиллярной крови избежать контакта с воздухом практически невозможно, но требуется свести его к минимуму.
10. Важный аргумент в пользу срочного исследования пробы - постоянный дрейф показателей КОС, связанный с продолжающимся процессом обмена веществ в клетках крови (поглощение кислорода и глюкозы, накопление углекислоты и лактата со сдвигом pH, возрастание уровня ионизированного кальция и др.) Показатели изменяются быстрее при высоком pO2, лейкоцитозе, лейкозах и лейкемоидных реакциях. Поэтому рекомендуется выполнение анализа не позднее 15-60 мин после взятия крови [12] (при лейкоцитозе и высоком исходном pO2 - в течение 5 мин). Если же это невозможно и требуется транспортировка образца, то
о
его нужно быстро охладить до +4 С в сосуде с тающим льдом; в таких условиях образец остается пригодным для исследования в течение часа. На бланке направления обязательно отмечается время взятия крови и Ф.И.О. сотрудника, выполняющего процедуру. Должна обеспечиваться максимально быстрая транспортировка пробы к месту Рис. 5. Пример правиль-
анализа в надлежащих температурных условиях, а ного перемешивания образца.
14
перед анализом необходимо согревание образца до комнатной температуры.
11. Гемолиз в образце может сильно исказить результаты анализа ионного состава и некоторые параметры КОС (калий, кальций, парциальное давление кислорода и углекислого газа) [16]. К сожалению, обнаружить небольшой гемолиз в цельной крови почти невозможно. Основной причиной его появления являются дефекты процедуры взятия крови - прокалывание сосуда насквозь и взятие крови из гематомы, повреждение окружающих тканей, неполное испарение дезинфектанта (спирта) с поверхности кожи и т.д. В образцах капиллярной крови гемолиз бывает значительно чаще, поскольку вытекающая после прокола пальца кровь неизбежно соприкасается с поврежденными тканями и с кожей, а ее выдавливание усиливает повреждение клеток. Кроме того, к гемолизу ведет длительное охлаждение образца крови. Снизить влияние указанных факторов и предотвратить гемолиз помогает использование специальных шприцов для артериальной крови, тщательное выполнение правил ее взятия и минимизация времени хранения образца перед анализом (по возможности -без охлаждения).
Критерии оценки качества оказания медицинской помощи
Формы: экстренная, неотложная
Виды: специализированная, в т.ч. высокотехнологичная, скорая Условия: стационарные Группы критериев:
• событийные: выполнение пробы Аллена перед процедурой. Использование специальных шприцев с напыленным на внутренние стенки сухим гепаринатом лития или натрия. Исследование артериальной крови: отсутствие гемолиза в пробе, отсутствие пузырьков воздуха в пробе;
• временные: общее время выдачи результатов анализа КОС не должно превышать 5-15 мин. от момента взятия пробы до выдачи результата, если условия не позволяют сразу провести анализ - охлаждение образца до +4 С в сосуде с тающим льдом, результат анализа - в течение часа.
• результативные: отсутствуют осложнения после пункции сосудов иглой (гематома, флебиты, артерииты).
15
(уровень доказательности 1А)
Катетеризация периферических и центральных вен - распространенная манипуляция в неотложной практической медицине. Каждый год в мире врачами устанавливаются свыше 500 миллионов периферических и более 15 миллионов центральных венозных катетеров. Катетеры широко используются в ситуациях, когда требуется частое или постоянное внутривенное введение лекарственных веществ [6].
Частота взятия крови из катетера в реальных клинических ситуациях подвержена изменениям. Согласно руководству А.А. Кишкуна [4], во избежание инфекционных осложнений кровь из катетера для клинико-лабораторных исследований рекомендуется брать не чаще одного раза в день. Однако у пациентов отделений реанимации есть необходимость повторного взятия крови в течение суток, иногда - каждый час. Особенно актуален такой способ получения крови у пациентов с низким давлением и спавшимися венами, а также у больных на гемодиализе, когда «дорога каждая вена», и у детей. Многократное пунктирование кубитальной вены обычным способом не рекомендуется из-за высокой частоты травматизации стенок сосудов и образования тромбов [16].
В настоящее время в России принят ГОСТ Р ИСО 15189-2012 [10], в его разделе «Правила ведения преаналитического этапа» рекомендуется использовать люэр-адапторы для присоединения к катетерам с целью взятия венозной крови для лабораторных исследований.
Для обеспечения доступа в сосудистое русло могут использоваться:
• периферические венозные катетеры;
• катетеры для периферических артерий;
• центральные венозные катетеры;
• центральные артериальные катетеры;
• катетеры в центральных венах, введенные через периферические вены. Определение вида катетера для конкретного пациента зависит от вида
оказания медицинских манипуляций и объема медицинской помощи. Для лабораторных исследований кровь можно брать как из центральных, так и из периферических венозных катетеров [9].
Существуют два основных способа взятия крови из катетера: 1. Способ трех шприцев. Первым шприцем из катетера отбирается и удаляется небольшое количество крови (3-5 мл), смешанной с последним вводившимся через катетер раствором или гепарином; вторым шприцем отбирается кровь на лабораторное исследование; третьим - катетер заполняется раствором гепарина («гепариновый замок»). Одним из основных проблем
16
2. Использование Люэр - или Люэр-Лок-адаптера. В последние годы
широкое распространение получают устройства безыгольного доступа, представляющие собой насадку с люэров-ской канюлей (адаптером), присоединяющейся к периферическому внутривенному катетеру. Люэр-адаптер с внутренней иглой (рис. 6) вначале вкручивается в держатель пробирки, а затем своей «лю-эровской» частью герметично вставляется в установленный ранее внутривенный катетер. Люэр-Лок-адаптер, интегрированный в держатель (рис. 7), сразу присоединяется к внутривенному катетеру при помощи крепления с резьбой. Преимуществом этих устройств является возможность взятия крови из катетера без использования иглы и шприца - напрямую в вакуумную пробирку для лабораторных исследований. Это позволяет снизить риск гемолиза и нарушения соотношения крови и реагента, находящегося в пробирке, а также обеспечивает дополнительную защиту медицинского персонала от уколов иглой.
Дискуссионной остается возможность взятия крови из внутривенного катетера для исследования параметров гемостаза. Даже небольшое количество гепарина, которым заполняют катетер для предотвращения его тромби-рования («гепариновый замок»), при попадании в пробу крови может дать картину ложной гипокоагуляции по тестам АЧТВ, ПВ и ТВ. В соответствии с ГОСТ Р 53079.4-2008, из катетеров, обработанных гепарином, брать кровь для исследования свертывающей системы не рекомендуется. Однако если на гемостаз кровь приходится брать из катетера, первые 5-10 мл крови, содержащих антикоагулянт или его следы, должны быть удалены, а на бланке направления необходимо сделать пометку о способе взятия крови для предупреждения врачей о возможности изменения результатов анализа.
В настоящее время в России не разработаны официальные стандарты установки внутрисосудистых катетеров, а также взятия крови из них для клинико-лабораторных исследований. Между тем, стандартизация всех этапов взятия крови из внутривенных катетеров необходима для:
• уменьшения количества венепункций у пациента;
• обеспечения достоверности результатов лабораторных исследований;

Рис. 6. Люэр- Рис. 7. Люэр-адаптер с Лок-адаптер с держателем. резьбовым креплением.
17
• предупреждения преаналитических ошибок и снижения их влияния на качество лабораторного исследования.
Для взятия крови из внутривенного катетера нужно подготовить:
• одноразовые перчатки;
• шприц для установки «гепаринового замка» после взятия крови из катетера;
• изотонический раствор хлорида натрия;
• раствор гепарина;
• Люэр-адаптер и держатель пробирки, либо держатель с Люэр-Лок-адаптером;
• пустую пробирку для взятия и удаления первой порции крови (не менее 35 мл);
• набор вакуумных пробирок для взятия крови (в зависимости от вида лабораторных исследований);
• контейнер для утилизации отходов класса Б.
Подготовка к процедуре:
1. Провести правильную идентификацию пациента по истории болезни (если пациент находится без сознания). Если пациент в сознании - уточнить у него фамилию, имя, отчество, провести маркировку пробирок в соответствие с правилами, принятыми в учреждении.
2. Подготовить пробирки для назначенных лабораторных исследований.
3. Вымыть руки с мылом, высушить и обработать 70° спиртом или специальными антисептиками, разрешенными к применению в данном учреждении.
4. Надеть стерильные перчатки (для профилактики инфекций, передаваемых при случайном уколе иглой)[8].
Выполнение процедуры (рис. 8):
1. Ввести через катетер 1-3 мл изотонического раствора хлорида натрия.
2. Проверить сроки годности адаптера и держателя, вскрыть упаковку. Вкрутить Люэр-адаптер внутренней иглой в держатель пробирки или взять держатель со встроенным Люэр-Лок-адаптером и внутренней иглой.
3. Снять с катетера колпачок-заглушку и присоединить его к адаптеру (в зависимости от типа вставить или вкрутить до упора).
4. Вставить в держатель пробирку для взятия и удаления первых 3-5 мл крови (пробирка затем помещается в контейнер для утилизации отходов класса Б).
5. Провести процедуру взятия крови в вакуумные пробирки в зависимости от цели исследования, соблюдая правило последовательности заполнения пробирок для лабораторных исследований. При использовании пробирок с
18
1) флакон для гемокультуры;
2) пробирка с активатором свёртывания для сыворотки;
3) пробирка для исследований системы гемостаза, с цитратом натрия;
4) пробирка с цитратом натрия для определения СОЭ;
5) пробирка с Li-гепарином;
6) пробирка с ЭДТА;
7) пробирка с ингибитором гликолиза для исследования лактата и глюкозы [5].
6. Немедленно после взятия перемешать содержимое каждой пробирки путем переворачивания 4-8 раз (в зависимости от типа пробирки). Пробирки поставить в штатив и промаркировать.
7. Отсоединить от внутривенного катетера держатель с адаптером.
8. Поместить адаптер в контейнер для утилизации отходов класса Б.
9. Шприцем ввести в катетер раствор гепарина (поставить «гепариновый замок»).
10. Закрыть катетер колпачком-заглушкой.
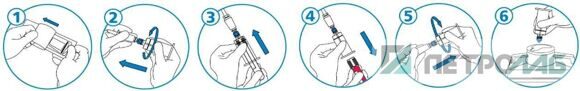
Рис. 8. Взятие крови из катетера с помощью Люэр-Лок-адаптера.
После проведения процедуры следует:
1. Указать в направлении, что взятие крови производилось из катетера, а также время взятия крови. Указать Ф.И.О. или номер сотрудника, который проводил процедуру.
2. Сразу же после взятия крови и маркировки поместить пробирки в штативы в вертикальном положении и в специальных контейнерах немедленно доставить в лабораторию.
Критерии оценки качества оказания медицинской помощи
Формы: экстренная, неотложная, плановая;
Виды: специализированная, в т.ч. высокотехнологичная, скорая, паллиативная;
Условия: стационарные;
Группы критериев:
• событийные: в направлении должно быть указано, что проба взята из катетера, использование Люэр - адаптера, держателя и вакуумных пробирок для взятия крови из катетера;
19
• результативные: отсутствуют осложнения после взятия крови из катетера (флебиты, артерииты, тромбозы).
• При необходимости экспертной оценки качества пробы для исключения ошибки на преаналитическом этапе референтным методом является определение индекса гемолиза пробы.
РЕКОМЕНДАЦИИ ПО ВЗЯТИЮ МОЧИ ИЗ МОЧЕВЫХ КАТЕТЕРОВ ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ (уровень доказательности 1Б)
Моча является вторым (после крови) наиболее часто исследуемым биоматериалом; анализы мочи производятся практически во всех медицинских лабораториях. Основная цель исследования мочи - уточнение диагноза различных заболеваний и мониторинг лечения, а также возможность выявления наркотических веществ. На современном этапе наметилась тенденция перехода от ручных методов исследования к автоматическим, что позволило расширить список определяемых компонентов мочи, а также дало возможность стандартизировать процедуру, тем самым обеспечивая высокое качество исследований [7].
Важнейшая роль в обеспечении качества анализов мочи связана с условиями правильного выполнения преаналитического этапа. К сожалению, эти условия часто недооцениваются. Между тем, многие компоненты мочи не отличаются стабильностью, и их сохранность в образце во многом зависит от
соблюдения правил взятия биоматериала.
Обычно исследуется моча, выделяемая естественным путем: пациент собирает ее либо сам, либо с помощью медицинских работников или окружающих. Однако, не у всех больных возможен сбор мочи таким путем: при нарушении выведения мочи, после оперативных вмешательств на органах урогенитального тракта, а также при тяжелом или критическом общем состоянии больного и пребывании его в
отделении реанимации и интенсивной терапии приходится прибегать к катетеризации мочевого пузыря. При этом в полость мочевого пузыря по мочеиспускательному каналу вводится катетер, и производится единовременная или постоянная эвакуации мочи.
При длительной катетеризации мочевого пузыря - от нескольких часов до одного месяца - используются катетеры Фолея, и лабораторному исследованию подвергается моча, получаемая через катетер. Это требует соблюдения определенных правил ее сбора, с учетом того, что параметры исследования будут отличными от тех, которые связаны со сбором мочи в естественных условиях. Поэтому в направлении на анализ следует обязательно указывать, что моча взята из катетера.
При естественном сборе мочи как правило используется утренняя, наиболее концентрированная ее порция; для этого разработаны референсные значения большинства аналитов. Кроме того, в процессе естественного мочеиспускания первая порция мочи «промывает» мочеиспускательный канал, поэтому для анализа берутся следующие, более «чистые» порции. При получении мочи из катетера эти условия становятся неактуальными: свойства мочи зависят не столько от времени суток, сколько от введения инфузионных растворов, лекарственных препаратов, состояния почек и других факторов, и по результатам анализа концентрация компонентов мочи, как правило, оказывается более низкой, чем обычно. Поскольку моча через катетер выходит напрямую из мочевого пузыря, то она на порции не делится. Кроме того, для клинических, биохимических и микробиологических исследований ее берут в любой момент времени по неотложным показаниям [2].
Для взятия мочи из уже установленного катетера целесообразно использовать специальные мочевые вакуумные системы (аналоги вакуумных систем для взятия венозной крови), состоящие из двусторонней иглы, держателя, вакуумных пробирок с консервантом или без него [11]. Вакуумные системы применяют двумя способами:
1. «Закрытый» способ (рис. 10): наружную часть установленного катетера Фолея прокалывают иглой с держателем, затем в держатель вставляют вакуумную пробирку, и она под влиянием вакуума заполняется мочой до нужного объема. Способ очень прост, но при его использовании существует риск прокола катетера насквозь и случайного укола иглой медицинского персонала, а после взятия мочи в катетере остается микроотверстие, которое может служить «воротами» для восходящего инфицирования мочевых путей.
Способ с использованием адаптера (рис. 11). Люэр-адаптер вкручивается в держатель пробирки и затем герметично вставляется в
21
Рис. 11. Взятие образца мочи из катетера с помощью Люэр-адаптера
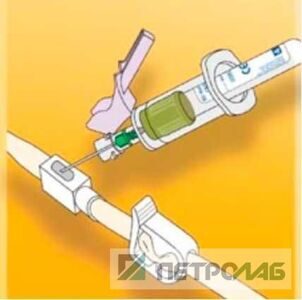
Рис. 10. Взятие образца мочи из катетера с помощью держателя с двухсторонней иглой.
2.

Микробная контаминация образца является одной из главных проблем анализа мочи. Некорректное выявление микробного агента ведет к неадекватному назначению антимикробной терапии, увеличению сроков лечения, а также к дополнительным финансовым издержкам, поскольку бактериологические исследования по сравнению с другими лабораторными тестами достаточно дороги. Взятие и транспортировка мочи в закрытых вакуумных системах позволяют в значительной мере предотвратить контаминацию и избежать ложных результатов анализов и ненужных дополнительных манипуляций.
Для взятия мочи из уже установленного катетера необходимы:
• одноразовые перчатки
• салфетки и 70° спирт или специальные антисептики, применяемые в данном учреждении для обработки рук и поверхности катетера;
• вакуумная пробирка для взятия и удаления первой порции мочи (не менее 3-5 мл);
• набор вакуумных пробирок для взятия мочи (в зависимости от вида лабораторных исследований);
• люэр-адаптер с внутренней иглой в резиновом колпачке и отдельно держатель для вакуумных пробирок, или держатель с внутренней иглой и встроенным Люэр-Лок-адаптером;
• непрокалываемый контейнер для утилизации отходов класса Б.
Подготовка к процедуре взятия мочи из катетера:
1. Провести идентификацию пациента, в том числе с помощью медицинской документации (истории болезни), поскольку пациенты могут быть в бессознательном состоянии;
2. Подготовить и промаркировать пробирки в соответствии с целью назначенных исследований; в направлении обязательно указать, что моча взята из катетера, время взятия биоматериала, указать Ф.И.О. или номер сотрудника, взявшего мочу на анализ.
5. Вымыть руки с мылом, высушить и обработать 70° спиртом или специальными антисептиками, разрешенными к применению в данном учреждении.
3. Надеть стерильные перчатки.
Взятие мочи из катетера «закрытым» способом:
1. Зажать трубку катетера ниже предполагаемого места прокола;
22
3. Провести дезинфекцию места планируемого взятия образца на катетере;
4. Вкрутить двустороннюю иглу для взятия крови/мочи в держатель, снять с иглы колпачок;
5. Пунктировать катетер в месте, обработанном дезинфицирующим средством, направляя иглу в сторону мочевых путей пациента;
6. Вставить пробирку в держатель и дождаться момента, пока моча, заполняя пробирку, не дойдет до метки; вынуть пробирку и перемешать содержимое путем переворачивания 8-10 раз (если пробирка содержит консервант);
7. Повторить предыдущий пункт требуемое количество раз до набора мочи во все необходимые пробирки;
8. Извлечь держатель с иглой и утилизировать их, поместив в контейнер для утилизации отходов класса «Б»;
9. Снять зажим с катетера;
10. Немедленно доставить образцы в лабораторию.
23
1. проверить сроки годности адаптера и вскрыть упаковку;
2. удостовериться, что катетер содержит мочу; поставить зажим на катетер или перегнуть его ниже предполагаемого места прокола;
3. продезинфицировать катетер в месте присоединения адаптера (на конце);
4. прикрепить адаптер к катетеру:
• (только для Люэр-адаптера): вкрутить адаптер с внутренней иглой в держатель; плотно вставить Люэр-адаптер в ответную часть катетера (до упора);
• (только для Люэр-Лок-адаптера): присоединить держатель со встроенным Люэр-лок-адаптером к катетеру (вкрутить до упора);
5. вставить пробирку в держатель и дождаться момента, пока моча не дойдет до метки пробирки;
6. вынуть пробирку и перемешать содержимое путем переворачивания 8-10 раз (если пробирка содержит консервант). Повторить предыдущий пункт требуемое количество раз до набора мочи во все необходимые пробирки;
7. снять (выкрутить) держатель с адаптером из катетера;
8. снять зажим с катетера, восстановив отток мочи;
9. утилизировать адаптер. Доставить образец в лабораторию.
Критерии оценки качества оказания медицинской помощи
Формы: экстренная, неотложная, плановая;
Виды: первичная медико-санитарная, специализированная, скорая, паллиативная;
Условия: амбулаторные, стационарные, дневной стационар; Группы критериев:
• событийные: в направлении на анализ мочи должно быть указано, что моча взята из катетера;
• использование закрытых вакуумных систем (двусторонняя игла или люэр-адаптер, держатель, вакуумная пробирка для сбора мочи);
• временные: от момента взятия пробы мочи до начала выполнения исследования - не более двух часов;
• результативные: отсутствуют осложнения в виде инфицирования мочевых путей.
ЗАКЛЮЧЕНИЕ
Отсутствие в России официальных рекомендаций по сбору первичных биологических образцов для лабораторных исследований при оказании экстренной и неотложной помощи является источником большого количества ошибок на преаналитическом этапе лабораторной диагностики.
Предложенные рекомендации по стандартизации процедур по взятию
24
СПИСОК ЛИТЕРАТУРЫ
1. Гильманов А.Ж. Современные технологии преаналитического этапа исследования газов и электролитов крови. - Медицинский алфавит. Современная лаборатория. - 2013. - Вып. 2. - С. 47-50.
2. Елисеев О.М. Справочник по оказанию скорой и неотложной помощи. Симптомы, синдромы и меры оказания неотложной помощи. Катетеризация мочевого пузыря. - М.: ТОО «Лейла», 2012.
3. Карпищенко А.И. Руководство для врачей «Медицинская лабораторная диагностика. Программы и алгоритмы». - М.: Издательская группа «ГЭОТАР - Медиа», 2014. - 569 с.
4. Кишкун А.А. Справочник заведующего клинико-диагностической лабораторией. М.: ООО Издательская группа «ГЭОТАР-Медиа», 2010. - 704 с.
5. Кочетов А.Г., Лянг О.В., Огурцов П.П. Подготовка пациента, правила взятия, хранения и транспортировки биоматериала для лабораторных исследований. Общие правила : методические рекомендации. - Москва : РУДН, 2013. - 39 с.
6. Крылова О. Итоги конференции «Единый стандарт периферического венозного доступа как возможность оптимизации работы ЛПУ». ФАРМ-индекс. - 2011. - Режим доступа: hnp://is.park.ru/doc.jsp?um=52454313.
7. Лопаткин Н.А. Руководство по урологии. Том 1. - М.: ГЭОТАР-Медиа, 2012.
8. Методические рекомендации по обеспечению и поддержанию периферического венозного доступа. Руководство для медицинских сестер. РАМС, СПб.: 2011. - 24 с.
9. Национальный стандарт Российской Федерации. ГОСТ Р 53079.4-2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналити-ческого этапа». М.: Стандартинформ, - 2009.
10. Национальный стандарт Российской Федерации. ГОСТ ИСО 15189-2012 «Лабораторные медицинские. Частные требования к качеству и компетентности». М.: Стандартинформ, 2012.
11. Диагностические пробы: от пациента до лаборатории / Гудер В.Г., Нарай-анан С., Виссер Г., Цавта Б. /пер. с англ. В.В.Меньшикова. GIT VERLAG 2009, Russian Version by Becton Dickinson & Co. (2010). - 118 с.
12. Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность. Санитарно-эпидемиологические правила и нормативы СанПиН 2.1.3.2630-10.
25
14. Procedures for the collection of arterial blood specimens; Approved Standard -Fourth Edition. NCCLS - CLSI Document H11-A4, Vol.24, No. 28 (2000)
15.Simundic A.M., Lippi G. Preanalytical phase - a continuous challenge for laboratory personals // Biochem. Med. (Zagreb). - 2012. - Vol. 22, № 2. - P.
145-149.
16. Reduction of hemolysis specimens coloring placement of phlebotomy personnel in the Emergency Department / Hirany S., Siddens l., Bowen M. [et al.] // Clin. Chem. - 2012. - Vol. 58, № 510. - P. A214.
17. Lippi G., Avanzini P., Cervellin G. Prevention of hemolysis in blood samples collected from intravenous catheters // Clin. Biochem. - 2013. - Vol. 46, № 78. - P. 561-564.
18. Baird G. Preanalytical consideration in blood gas analysis // Biochem. Med. (Zagreb). - 2013. - Vol. 23, № 1. - P. 19-
